中國藥品監(jiān)督管理局(CFDA,現(xiàn)為國家藥品監(jiān)督管理局NMPA)逐步優(yōu)化藥品審評審批流程,其中原料藥與藥品的共同審評審批是一個重要環(huán)節(jié)。這一改革旨在提高藥品質(zhì)量、降低企業(yè)成本,并加快藥品上市速度。結(jié)合金融知識流程外包(KPO)的理念,可以更好地理解這一流程的高效性和協(xié)同性。
一、背景與意義
原料藥是藥品生產(chǎn)的核心組成部分,其質(zhì)量直接關(guān)系到藥品的安全性和有效性。傳統(tǒng)的審評審批中,原料藥和制劑藥品需分別提交申請,導(dǎo)致時間成本高、資源浪費。共同審評審批制度通過整合申請資料,簡化流程,提高了整體效率。金融知識流程外包作為現(xiàn)代服務(wù)模式,強調(diào)專業(yè)知識和流程優(yōu)化,與藥品審評的理念不謀而合,即通過標準化和外包思維提升管理效率。
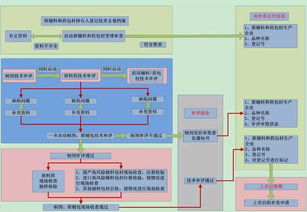
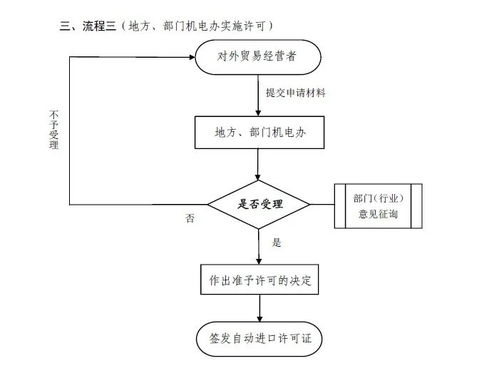
二、CFDA共同審評審批流程詳解(一圖概覽)
根據(jù)CFDA發(fā)布的流程圖,共同審評審批主要包括以下步驟:
1. 申請?zhí)峤唬浩髽I(yè)同時提交原料藥和藥品的申請資料,包括藥學(xué)、非臨床和臨床數(shù)據(jù)。
2. 形式審查:CFDA對資料的完整性進行初步審核,確保符合要求。
3. 技術(shù)審評:專家團隊對原料藥和藥品的質(zhì)量、安全性和有效性進行同步評估,重點關(guān)注原料藥的穩(wěn)定性、雜質(zhì)控制和與藥品的相容性。
4. 現(xiàn)場檢查:必要時,對原料藥生產(chǎn)場地和藥品生產(chǎn)企業(yè)進行現(xiàn)場核查。
5. 綜合審評:基于技術(shù)審評和檢查結(jié)果,形成綜合意見,決定是否批準。
6. 審批決定:通過后,頒發(fā)藥品注冊證書和原料藥關(guān)聯(lián)審評通過證明。
整個流程強調(diào)數(shù)據(jù)共享和協(xié)同評估,減少了重復(fù)環(huán)節(jié),通常可將審批時間縮短30%以上。
三、金融知識流程外包(KPO)的啟示
金融KPO涉及將專業(yè)知識密集型流程外包給專業(yè)機構(gòu),以提升效率和準確性。在藥品審評中,可以借鑒這一模式:
- 流程優(yōu)化:通過外包思維,將部分審評環(huán)節(jié)(如數(shù)據(jù)分析和風(fēng)險評估)委托給第三方專業(yè)機構(gòu),提高審評質(zhì)量。
- 資源整合:類似于KPO中的知識管理,CFDA可以建立共享數(shù)據(jù)庫,促進原料藥和藥品數(shù)據(jù)的互通,減少企業(yè)負擔(dān)。
- 風(fēng)險管理:應(yīng)用金融領(lǐng)域的風(fēng)險評估工具,加強對原料藥供應(yīng)鏈的監(jiān)控,確保藥品安全。
四、優(yōu)勢與挑戰(zhàn)
共同審評審批的優(yōu)勢顯而易見:加速藥品上市、降低企業(yè)成本、提升監(jiān)管效率。挑戰(zhàn)也不容忽視,例如企業(yè)對流程的適應(yīng)、數(shù)據(jù)標準化問題,以及監(jiān)管資源的分配。借鑒金融KPO的經(jīng)驗,可以通過培訓(xùn)、技術(shù)支持和國際合作來應(yīng)對這些挑戰(zhàn)。
五、結(jié)語
原料藥與藥品共同審評審批是CFDA改革的重要舉措,結(jié)合金融知識流程外包的理念,可以進一步推動藥品產(chǎn)業(yè)的創(chuàng)新與發(fā)展。隨著數(shù)字化和人工智能的應(yīng)用,這一流程有望更加智能高效,為公眾健康提供更強保障。企業(yè)應(yīng)積極適應(yīng)新規(guī),加強內(nèi)部管理,以抓住機遇。